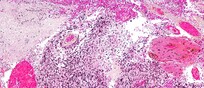
In Italia, oltre il 30% dei pazienti con tumori avanzati può essere curato con terapie mirate grazie all'oncologia di precisione, che guarda al profilo genetico del tumore più che all'organo colpito. Per applicarla, servono test come il Next Generation Sequencing (Ngs), capaci di analizzare centinaia di geni, e i Molecular Tumor Board (Mtb), per valutare il significato biologico e clinico delle mutazioni, che possono essere trattate con farmaci mirati o con l'immunoterapia. Eppure l'uso di questi strumenti è ancora basso: solo il 2% delle biopsie viene analizzato con Ngs, contro il 10% in Europa. E solo 12 Regioni su 21 hanno un Mtb regionale. Affinché il modello mutazionale si affermi davvero, è necessario creare una rete nazionale strutturata di Mtb in collaborazione con le Reti Oncologiche Regionali, e istituire un centro di coordinamento nazionale che ne monitori l'attività. È la richiesta lanciata oggi dall'Italian Summit on Precision Medicine, organizzato dalla Fondazione per la Medicina Personalizzata (Fmp), che riunisce oltre 150 esperti.
"Nel modello mutazionale - spiega Paolo Marchetti, Presidente Fmp - i farmaci vengono indicati dal Molecular Tumor Board a seguito della profilazione genomica di pazienti metastatici, per i quali le cure standard non abbiano evidenziato benefici. In questo nuovo paradigma, i trattamenti risultano off-label in presenza di mutazioni con sede diversa da quella autorizzata oppure perché sono farmaci in fase di sviluppo e, quindi, non ancora autorizzati e rimborsati. L’aspetto più complesso riguarda l’accesso e la copertura finanziaria delle terapie in base alle decisioni assunte dall’MTB”.In questo nuovo paradigma, l'aspetto più complesso riguarda l'accesso e la copertura finanziaria delle terapie in base alle decisioni assunte dall'Mtb". In alcune neoplasie, ad esempio nei tumori del polmone e nel colangiocarcinoma, precisa l'esperto, "è suggerito l’impiego di pannelli per l’analisi di un numero limitato di biomarcatori per i quali sono disponibili farmaci approvati per la pratica clinica. L’utilizzo di pannelli più ampi, in grado di effettuare quella che è definita profilazione genomica estesa, è invece raccomandato in neoplasie selezionate in cui non vi sono bersagli molecolari noti, come nei tumori di origine sconosciuta oppure nei casi in cui è necessario analizzare biomarcatori complessi, come il deficit di ricombinazione omologa nei carcinomi dell’ovaio. L’esecuzione di test di profilazione genomica estesa è anche raccomandata in pazienti con tumori solidi avanzati che abbiano esaurito le linee di terapia standard, nei quali questo approccio può individuare alterazioni genomiche che consentano ai pazienti di accedere a studi clinici o a farmaci in corso di approvazione attraverso i Molecular Tumor Board”.
"L'innovazione sta cambiando l'approccio standard alla gestione del cancro, sostituendo il modello della medicina basata sulla stratificazione dei pazienti in base a fattori predittivi di risposta - dichiara Andrea Botticelli, Oncologia Medica A, Policlinico Umberto I, Sapienza-. Quest'ultimo riduce il numero di pazienti da trattare per ottenere un vantaggio clinicamente rilevante, mentre il modello mutazionale consente di ampliare il numero di persone che possono trarre vantaggio da una specifica terapia". Per Giuseppe Curigliano, Presidente eletto Esmo (Società Europea di Oncologia Medica), "bisogna accelerare l'istituzione dei Molecular Tumor Board, perché sono gli unici organismi in grado di sfruttare le potenzialità dell'oncologia mutazionale. Attualmente, sono stati istituiti solo in alcune Regioni. Inoltre, un obiettivo cruciale è il completamento della Piattaforma Genomica Nazionale".
La Legge n. 233 del 29 dicembre 2021, ha stabilito l'istituzione di una rete strutturata di Mtb, che operi in collaborazione con le Reti Oncologiche Regionali, di un centro di coordinamento nazionale e la creazione di Centri per l'esecuzione dei test Ngs in ogni Regione, ma "ad oggi non è stata ancora del tutto attuata", conclude Marchetti.
Riproduzione riservata © Copyright ANSA